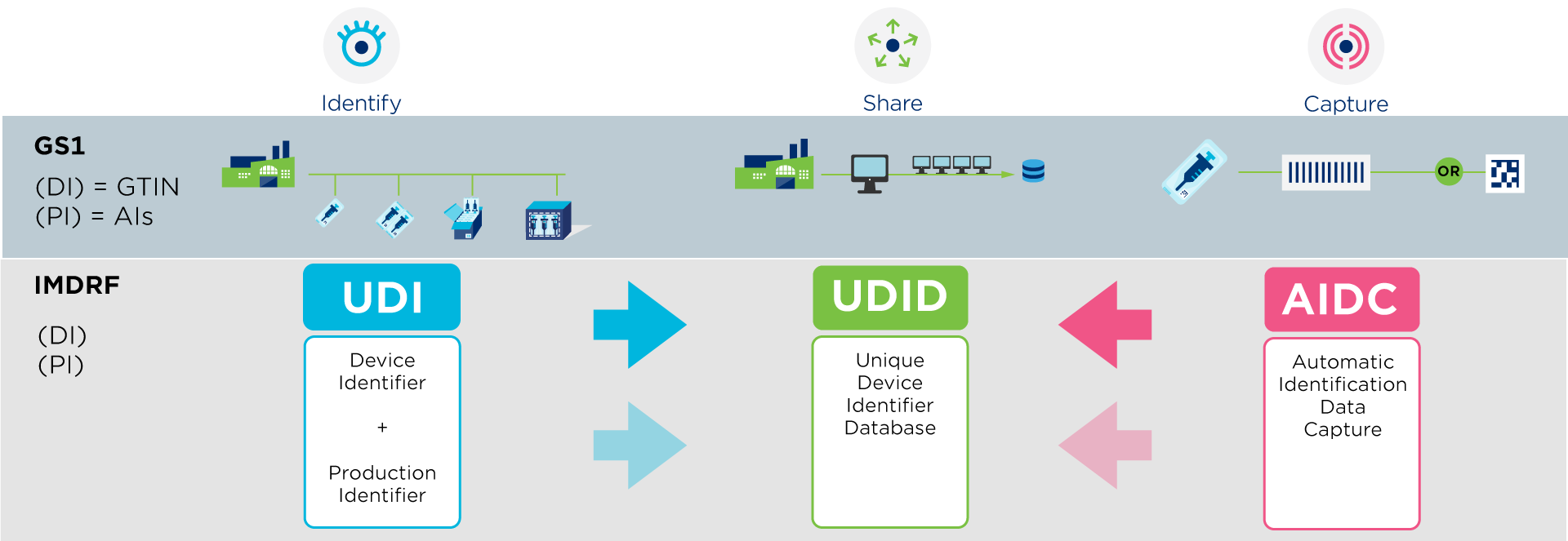
Un UDI (Unique Device Identifier) est un code unique au monde pour identifier des dispositifs médicaux. Il est composé de deux parties:
- Un UDI-DI (Device Identifier ou DI): la partie fixe du code qui identifie de manière unique chaque dispositif médical via un GTIN.
- Un UDI-PI (Production Identifiier ou PI): la partie variable qui ajoute des informations de production, comme le numéro de lot, le numéro de série ou la date d’expiration.
La réglementation internationale, telle que le MDR et l’IVDR en Europe et les directives de la FDA aux États-Unis, impose aux fournisseurs d’attribuer un UDI à tous les dispositifs médicaux.
GS1 est un organisme accrédité pour l'émission des UDI qui vous aide à se conformer aux réglementations internationales, comme EU MDR IVDR et US FDA, qui exigent des fournisseurs qu'ils attribuent un UDI à leurs produits.
En Europe, l’UDI-DI est également utilisé pour constituer le Basic UDI-DI.

La conformité aux exigences UDI pour les dispositifs médicaux repose sur trois principes, tels que définis par l’International Medical Device Regulators Forum (IMDRF). Ces lignes directrices mondiales constituent la base de la législation nationale, afin que chaque région puisse répondre à ses exigences spécifiques.
- L’identification des dispositifs médicaux au moyen d’un UDI.
- La possibilité de scanner les informations via un code à barres. Ainsi, les codes à barres GS1 DataMatrix et GS1-128 sont autorisés dans l’Union européenne et contiennent, dans un seul code à barres, toutes les informations légalement requises.
- Le partage des informations produit dans une base de données réglementaire, telle qu’EUDAMED pour l’Union européenne ou la GUDID aux États-Unis.